愛媛大学大学院農学研究科渡辺誠也教授らの研究グループは、アコニターゼファミリーのタンパク質の中で唯一機能が不明だったアコニターゼX が、シス-3-ヒドロキシ-L-プロリン(C3LHyp)脱水酵素として働くことを世界で初めて明らかにしました。その際、AcnX と既知のアコニターゼのアミノ酸配列との相同性(“見かけ”)よりも、その遺伝子が細菌ゲノム上でL-ヒドロキシプロリン代謝遺伝子クラスター内に見られること(“周り”)に注目しました。C3LHyp脱水酵素の基質と触媒する化学反応は既知のアコニターゼファミリーの酵素とは全く似ていないことから、本法は現在のタンパク質機能推定に新たな一石を投じると期待されます。
本研究成果は、2016年12月8日(日本時間12月8日19時)にNature Publishing Group の発行する学術誌「Scientific Reports」オンライン版に掲載されました。
掲載論文
Functional characterization of aconitase X as a cis-3-hydroxy-L-proline dehydratase.
掲載誌
Scientific Reports 6:38720 (2016), DOI: 10.1038/srep38720
著者
Seiya Watanabe, Kunihiko Tajima, Satoshi Fujii, Fumiyasu Fukumori, Ryotaro Hara, Rio Fukuda, Mao Miyazaki, Kuniki Kino, Yasuo Watanabe
研究の概要
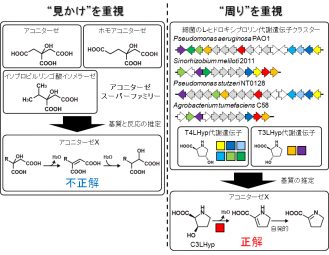 アミノ酸配列に相同性があるタンパク質(酵素)は、タンパク質ファミリーを形成します。さらにその中では、類似した機能や反応様式を持つメンバーがサブファミリーを形成しています。これは、進化の過程で単一祖先の遺伝子が重複することでタンパク質ファミリーが生じたためと考えられています(リクルート仮説)。
アミノ酸配列に相同性があるタンパク質(酵素)は、タンパク質ファミリーを形成します。さらにその中では、類似した機能や反応様式を持つメンバーがサブファミリーを形成しています。これは、進化の過程で単一祖先の遺伝子が重複することでタンパク質ファミリーが生じたためと考えられています(リクルート仮説)。
アコニターゼファミリーには、4つのサブファミリーが存在しています。このうち、アコニターゼ、ホモアコニターゼ、イソプロピルリンゴ酸イソメラーゼの3つについては、類似した構造を持つ基質のヒドロキシル基と特定の水素原子を取り出し立体化学的に異性化する反応を触媒します。すなわち、このタンパク質ファミリーの進化はリクルート仮説で説明できる典型例であるといえます。これに対しアコニターゼX(サブファミリー)には既知の活性が見られないことから、これまで機能未知タンパク質に分類されてきました。
一方、渡辺教授らはこれまでに細菌のトランス-4-ヒドロキシ-L-プロリン(T4LHyp)やトランス-3-ヒドロキシ-L-プロリン(T3LHyp)の代謝経路の解明を行ってきました。その過程で、アコニターゼX遺伝子がこうしたL-ヒドロキシプロリン代謝遺伝子が集まったクラスター内にしばしば位置することに気が付きました。そこで、T4LHypやT3LHyp以外の多数のL-ヒドロキシプロリン化合物をアコニターゼXの基質候補として与えてみたところ、シス-3-ヒドロキシ-L-プロリン(C3LHyp)のみが速やかに消費されました。さらにその後の反応生成物の分析から、アコニターゼX がC3LHyp 脱水酵素として機能することが分かりました。
※詳細はプレスリリース資料をご参照ください。

