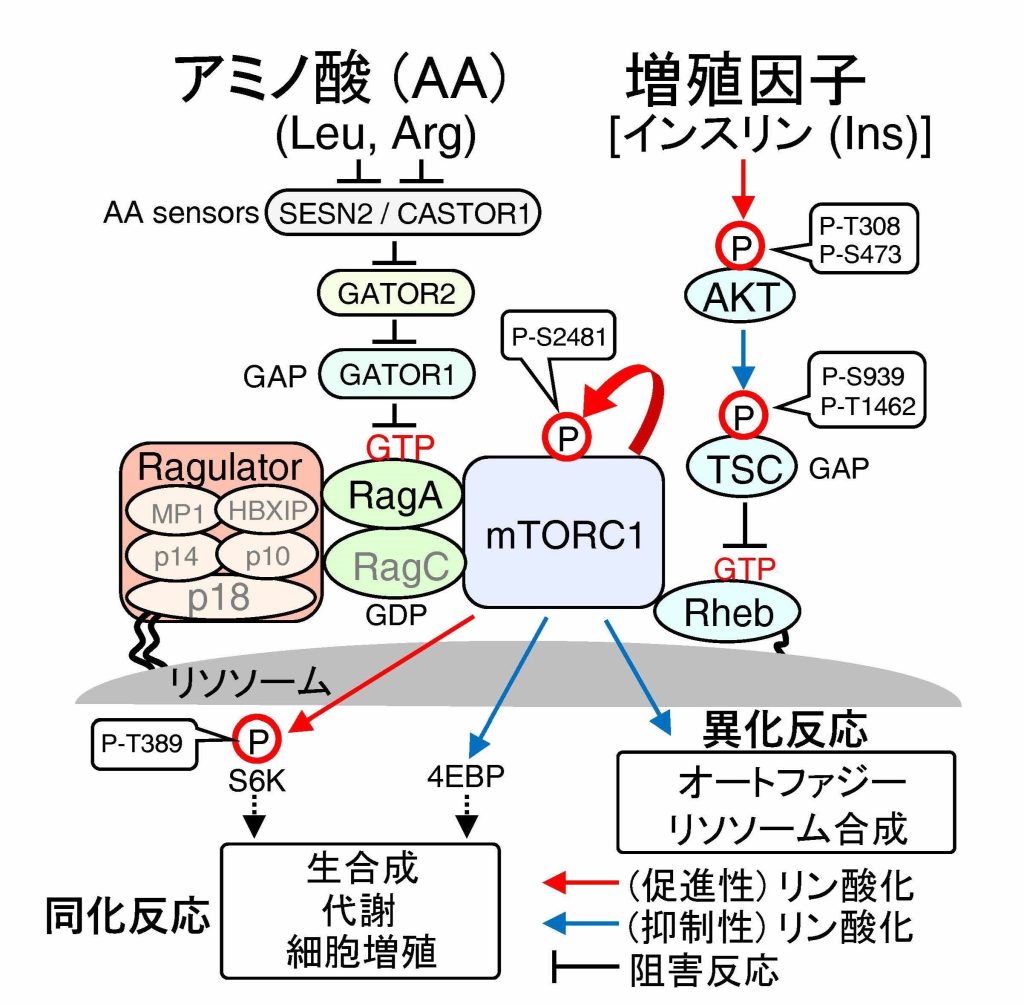
リソソーム膜上におけるTSC2の選択的脱リン酸化がmTORC1の活性を厳密に制御する
愛媛大学先端研究院プロテオサイエンスセンター病理学部門 中村貴紀助教、増本純也教授、澤崎達也教授の研究グループは、東京大学医科学研究所 武川睦寛教授、大阪大学先端モダリティ・DDS研究センター 岡田雅人特任教授、同数理・データ科学教育研究センター 鈴木貴特任教授(常勤)、新潟大学大学院医歯学総合研究科 松本雅記教授、東京科学大学 生命理工学院 生命理工学系(神奈川県立がんセンター兼任) 越川直彦教授らとの共同研究で、栄養シグナル伝達の中心的役割を担うタンパク質複合体mTORC1の活性制御機構を解明することに成功しました。
研究の概要
mTORC1は、アミノ酸経路及びインスリン経路(AKT-TSC1/2-Rheb)によってリソソーム膜上で活性化し、体内の栄養状態に応じて、生体成分であるタンパク質、脂質、核酸などを合成するか、または分解するかを決定し、生命の恒常性維持を担います。mTORC1の機能破綻はがんや糖尿病など代謝性疾患を惹起するため、mTORC1の活性化は厳密に制御されますが、その詳細な分子機構は不明な点が多く残されています。今回我々は、近接ビオチン標識(Lyso BioID)などの実験手法と理論手法(数理解析)を駆使して、mTORC1シグナル経路の統合的理解を目指しました。その結果、インスリン刺激に伴うAKTキナーゼは、細胞内アミノ酸濃度に関係なく活性化されましたが、低アミノ酸レベルでは、AKTの基質分子でmTORC1経路のブレーキ役となるTSC2が、リソソーム膜上で脱リン酸化酵素PP2Aによって選択的に脱リン酸化されることを新たに見出しました。この脱リン酸化反応は、mTORC1がアミノ酸及びインスリンを同時に感知した場合のみ活性化することを保証する分子機構の1つであることを明らかにしました。さらに、結節性硬化症(指定難病158)及びがん症例の中に、TSC2のPP2A結合能を消失する遺伝子変異を見出しており、PP2A-TSC2によるmTORC1経路のブレーキ機能が破綻すると、上記のTSC2関連疾患の発症を惹起することも解明しました。
本研究成果は、9月2日10時(米国東部時間)に、米国の国際科学雑誌「Life Science Alliance」に掲載されました。
研究成果のポイント
- 質量分析を活用して、mTORC1経路(図1)の構成タンパク質の細胞内濃度測定(iMPAQT)、リソソーム膜上タンパク質の網羅的同定(Lyso-BioID)を実施しました。
- 上記実測データを基に、mTORC1経路の数理モデルを構築して、mTORC1経路の活性制御機構を解明しました。
- インスリン刺激によって活性化されたAKTは、TSC2をリン酸化して、TSC1/2のブレーキ機能(GAP活性)を阻害しますが、アミノ酸除去時では、TSC2のリン酸化レベルは、アミノ酸添加時と比べて有意に低いことを明らかにしました。
- アミノ酸除去時にはTSC2はリソソーム膜上に移動してPP2Aによって選択的に脱リン酸化されることを明らかにしました。
- PP2A-TSC2を介したmTORC1経路の制御は、mTORC1がアミノ酸と増殖因子(インスリン)を同時に感知した場合のみ活性化することを保証するシステムであり、その破綻は、がんや、結節性硬化症などの疾患発症を惹起することも明らかにしました。
論文情報
掲載誌:Life Science Alliance
題名:Amino acid-dependent TSC2 dephosphorylation by lysosome-PP2A regulates mTORC1 signaling transduction
(和訳)リソソームPP2AによるTSC2のアミノ酸濃度に依存した脱リン酸化がmTORC1栄養シグナル伝達を制御する
著者:Takanori Nakamura*, Shigeyuki Nada, Masaki Matsumoto, Nuha Loling Othman, Hidetaka Kosako, Kazuki Ikeda, Naohiko Koshikawa, Junya Masumoto, Tatsuya Sawasaki, Mutsuhiro Takekawa, Takashi Suzuki*, and Masato Okada*
*共責任著者:中村 貴紀、 鈴木 貴、 岡田 雅人
DOI:10.26508/lsa.202503206
愛媛大学 プロテオサイエンスセンター 病理学部門 医学系研究科 解析病理学講座
中村 貴紀 大学院担当助教(テニュア育成)