愛媛大学大学院農学研究科の渡辺誠也 教授(沿岸環境科学研究センター教授 兼任)(ARG生命機能科学応用開発グループ グループ長)らの研究グループは、細菌のL-アラビノース代謝経路に関わる酵素の一つであるL-2-ケト-3-デオキシアラボン酸(L-KDA)脱水酵素(以下、AraD)の立体構造を、X線結晶回折法により詳細に明らかにしました。
AraDは、DHDPS/NALと呼ばれる大きなタンパク質ファミリーのメンバーです。ところが、他のメンバーの大半はアルドール開裂(縮合)を触媒するものであることから、AraDの見た目(アミノ酸配列)と中身(機能)には大きなギャップがあり、その原因は長らく不明のままでした。今回の結晶構造から明らかになったAraDの活性中心には、他のDHDPS/NALメンバーが共通して持つチロシン残基(黄緑)がない一方で、AraDにしかないグルタミン酸残基(水色)が少しずれた位置に配置されています。他のDHDPS/NALメンバーではこのチロシン残基は基質のC4水酸基のプロトンを引き抜きますが、AraDではグルタミン酸残基がC3プロトンを引き抜くことで、L-KDAのその後の運命がまったく変わることが分かりました。同じ基質に対して異なる反応を触媒する酵素がごく少数のアミノ酸残基の置換により生じることを示すこれらの成果は、酵素の分子進化機構に新しい知見を与えると考えられます。
10年以上前に渡辺教授ら(当時 京都大学)が決定していたAraDの構造は、活性部位に何も結合していないものだったため得られる情報は限定的でした。今回、生化学研究室に所属していた2人の学生が、基質に似た化合物が結合した構造を延べ4年間に渡る努力の末に決定したことで、大きな進展が得られました。
本研究成果は、2020年7月22日(米国時間)に米化学会誌Biochemistryにオンライン掲載されました。
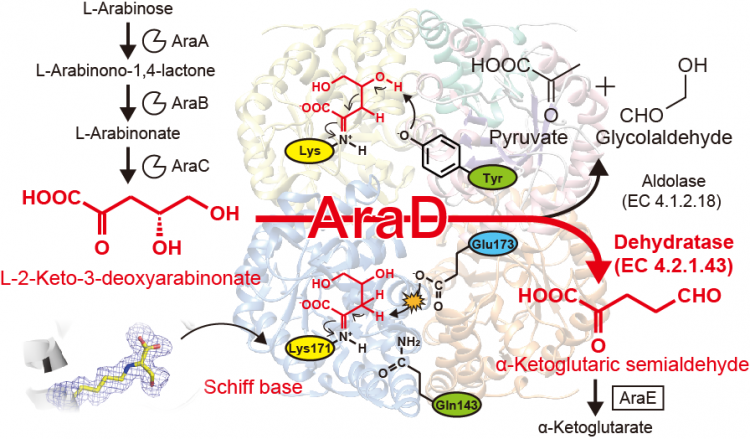
L-アラビノース代謝経路とAraDの反応の模式図
【論文情報】
掲載誌:Biochemistry
題名:Biochemical and structural characterization of L-2-keto-3-deoxyarabinonate dehydratase: A unique catalytic mechanism in the Class I aldolase protein superfamily.
DOI:https://doi.org/10.1021/acs.biochem.0c00515
著者:Seiya Watanabe‡§¶1, Yasunori Watanabe‡§1,2, Rika Nobuchi§, and Akari Ono§
‡ Department of Bioscience, Graduate School of Agriculture, Ehime University, 3-5-7 Tarumi, Matsuyama, Ehime 790-8566, Japan
§ Faculty of Agriculture, Ehime University, 3-5-7 Tarumi, Matsuyama, Ehime 790-8566, Japan
¶ Center for Marine Environmental Studies (CMES), Ehime University, 2-5 Bunkyo-cho, Matsuyama, Ehime 790-8577, Japan
1 These authors contributed equally to this work.
2 Present address: Faculty of Science, Yamagata University, 1-4-12 Kojirakawa-machi, Yamagata, Yamagata 990-8560, Japan
<農学研究科>

