大学院農学研究科の渡辺誠也教授(沿岸環境科学研究センター教授 兼任)(ARG生命機能科学応用開発グループ グループ長)は、プロリンラセマーゼファミリーに属し活性部位に2個のシステイン残基を持つ細菌由来の2つの酵素が、片方はL-ヒドロキシプロリンの異性化反応を、もう片方は脱水反応をそれぞれ触媒することを明らかにしました。一般的に酵素機能は活性部位と呼ばれるごく少数のアミノ酸残基に支配されていますが、今回の発見は酵素機能が変化する際に活性部位の変化が必須ではないことを示しており、酵素の分子進化機構に新しい知見を与えると考えられます。
本研究成果は、2017年5月30日(米国時間)に微生物学分野の著名ジャーナルであるJournal of Bacteriologyにオンライン掲載されました。
概要
アミノ酸配列に相同性があるタンパク質(酵素)は、タンパク質ファミリーを形成します。さらにその中では、類似した機能や反応様式を持つメンバーがサブファミリーを形成しています。酵素を構成する数百~数千個のアミノ酸残基のうち、基質(化学反応に使われる化合物)が結合する「活性部位」を構成するのは少数です。つまり、タンパク質ファミリーにおけるサブファミリー間では活性部位が異なるということになります。
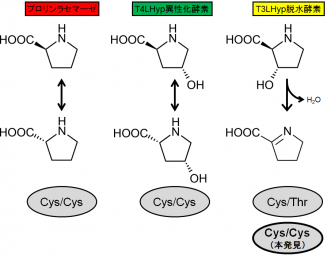
プロリンラセマーゼファミリーには、プロリンラセマーゼ、トランス-4-ヒドロキシ-L-プロリン(T4LHyp)異性化酵素、トランス-3-ヒドロキシプロリン(T3LHyp)脱水酵素の3つのサブファミリーが存在しています。このうち、最初の2つは基質の種類は違いますがどちらもL体 ↔ D体の立体異性を変える反応であり、活性部位は2個のシステイン残基(Cys/Cys)が向かい合うように配置されています。これに対し、3番目の脱水酵素の活性部位の片方はスレオニンに変わっており(Cys/Thr)、上記の理論でよく説明できるとされてきました。
通常の細菌のL-ヒドロキシプロリン代謝に関わる遺伝子の集まり(クラスター)にはCys/CysとCys/Thrの酵素が1個ずつ含まれており、それぞれがT4LHyp異性化酵素とT3LHyp脱水酵素として機能しています。ところが、ごく少数ではありますがCys/Cysの酵素を2個含む場合があります(HypA1とHypA2)。今回、これに注目してその酵素機能を詳しく解析した結果、驚くべきことにHypA2はT3LHp脱水酵素であること、さらに脱水活性の1/10程度ではありますがT3LHypの立体異性を変える異性化反応も触媒できることが明らかとなりました。一方、HypA1は活性部位から予想されたようにT4LHyp異性化酵素としてのみ機能しました。
研究成果のポイント
Cys/Cysという同じ活性部位を持つ酵素が「異性化」と「脱水」という全く異なる化学反応を触媒できるという事実は、「酵素機能の変化には活性部位の変化が必須である」というこれまでの理論では説明が困難です。加えて、アミノ酸配列から見るとHypA2は既知のT3LHyp脱水酵素と最も似ていますから、T3LHyp脱水酵素サブファミリーの中で「Cys/Cys ↔ Cys/Thr」という活性部位の変化が生じても機能は変化しなかったということになります。今回の発見は、酵素の分子進化において「活性部位を維持しつつ新しい機能を獲得できる高い潜在能力」を示したともいえます。
本研究の一部は、JSPS科学研究費補助金基盤研究(C)(16K07297;研究代表者 渡辺誠也)および住友財団 基礎科学研究助成(研究代表者 渡辺誠也)の支援を受けて行われました。
論文情報
掲載誌:Journal of Bacteriology
題名:Characterization of a novel cis-3-hydroxy-L-proline dehydratase and a trans-3-
hydroxy-L-proline dehydratase from bacteria.
DOI:http://jb.asm.org/content/early/2017/05/23/JB.00255-17
著者:Seiya Watanabe1,2,3, Fumiyasu Fukumori4, Mao Miyazaki2, Shinya Tagami2,
Yasuo Watanabe1,2
1 Department of Bioscience, Graduate School of Agriculture, Ehime University, Ehime, Japan
2 Faculty of Agriculture, Ehime University, Ehime, Japan
3 Center for Marine Environmental Studies (CMES), Ehime University, Ehime, Japan
4 Faculty of Food and Nutritional Sciences, Toyo University, Gunma, Japan
<大学院農学研究科>

