令和4年11月9日(水)~11日(金)に名古屋国際会議場で開催された「第95回日本生化学大会」において、大学院農学研究科生命機能学専攻応用生命化学コース生化学教育分野所属2年生の吉原健太郎さんが「若手優秀発表賞」を受賞しました。
日本生化学会は大正14年に設立され、日本国内の生命科学分野で最も大きな学会のひとつです。今年の大会は3年ぶりに対面で開催され、計494題の研究発表が3日間に渡り行われました。「若手優秀発表賞」は、在学中または学位(学士、修士、博士のいずれか)取得後3年以内で、口頭発表の内容と質疑応答が特に優れた若手発表者に授与されるもので、今回は63人が受賞しました。
受賞タイトル
バイオエタノール生産の鍵酵素であるキシリトール脱水素酵素の構造生物学的および生化学的解析
(The structural and biochemical analysis of xylitol dehydrogenase, a key enzyme for bioethanol production)
指導教員:大学院農学研究科・渡辺誠也教授
概要
食料と競合しないリグノセルロース系バイオマスには、六炭糖であるグルコースに加えヘミセルロース成分に由来するD-キシロース(五炭糖)が大量に含まれています。バイオエタノール生産に最もよく使われるサッカロミセス酵母はこれを発酵できないため、他の微生物が持っているD-キシロース発酵に必要な2つの遺伝子を導入する必要がありますが、キシリトール脱水素酵素(XDH)はその一つです。このように産業的に重要なXDHの立体構造を初めて決定するとともに、構造安定化亜鉛と呼ばれる亜鉛原子の酵素機能に与える影響と分子進化について新知見を得たことが高く評価され、今回の受賞に至りました。
吉原さんのコメント
今回このような賞を頂き光栄です。学会での発表賞にはこれまで縁が無かったので、なおさら嬉しく思っています。もちろん私自身だけの力ではなく、実験や発表内容についてご指導くださった渡辺誠也先生のおかげです。修了まであと少しですが、この受賞を胸に最後まで全力で研究に励みたいと思います。
国際学術誌Scientific Reportsにオンライン掲載されました(令和5年2月2日(木))
このたび、愛媛大学大学院農学研究科 渡辺誠也教授(沿岸環境科学研究センター教授 兼任)、同研究科2年生 吉原健太郎さん、山形大学理学部 渡邊康紀講師の研究グループは、産業的に重要な酵素である酵母菌Pichia stipitis由来のキシリトール脱水素酵素(PsXDH)の立体構造を、X線結晶回折法により世界で初めて明らかにしました。本研究は、カーボンニュートラルな炭素源で非食料植物バイオマスを原料とするバイオエタノールを初めとした有用化成品の発酵生産の向上に貢献するものです。
本研究成果は、令和5年2月2日(木)に英国Springer Nature Groupが刊行する国際学術誌Scientific Reportsにオンライン掲載されました。なお、本研究の一部は農学研究科研究グループARG(生命機能科学応用開発グループ:グループ長 渡辺誠也)の支援を受けて行われました。
産業的に重要なキシリトール脱水素酵素の立体構造を世界で初めて決定
~非食料植物バイオマスからのグリーンケミストリーに貢献~
大気中の二酸化炭素が光合成によって固定化された植物バイオマスを物質生産、例えばバイオエタノールの原料にした場合、燃焼により排出される二酸化炭素は再び固定化されるため、地球全体の二酸化炭素濃度は増減しないというカーボンニュートラルが成り立ちます。植物バイオマスのうち、農作物系は食料と競合するため、未利用資源であるリグノセルロース系(農業残渣や間伐材など)の利活用が求められます。お酒やワインの醸造に使われる出芽酵母(Saccharomyces cerevisiae)は、グルコース(六炭糖)からのエタノール発酵とアルコール耐性に優れていますが、リグノセルロース系に大量に含まれるD-キシロース(五炭糖)を代謝することができません。そこで、固有にD-キシロース代謝能を有する別の酵母菌であるPichia stipitisのD-キシロース代謝遺伝子であるD-キシロース還元酵素(XR)とキシリトール脱水素酵素(XDH)をS. cerevisiaeを導入してD-キシロース代謝能を付与しています。しかし、この遺伝子組み換え酵母菌によるD-キシロース発酵では、副産物としてキシリトールが蓄積し、エタノール変換効率が低下するという大きな問題がありました。この主な原因はXDHの酵素的機能にあると考えられており、それをタンパク質工学的手法で改善するために必要不可欠な立体構造情報はこれまで未知のままでした。
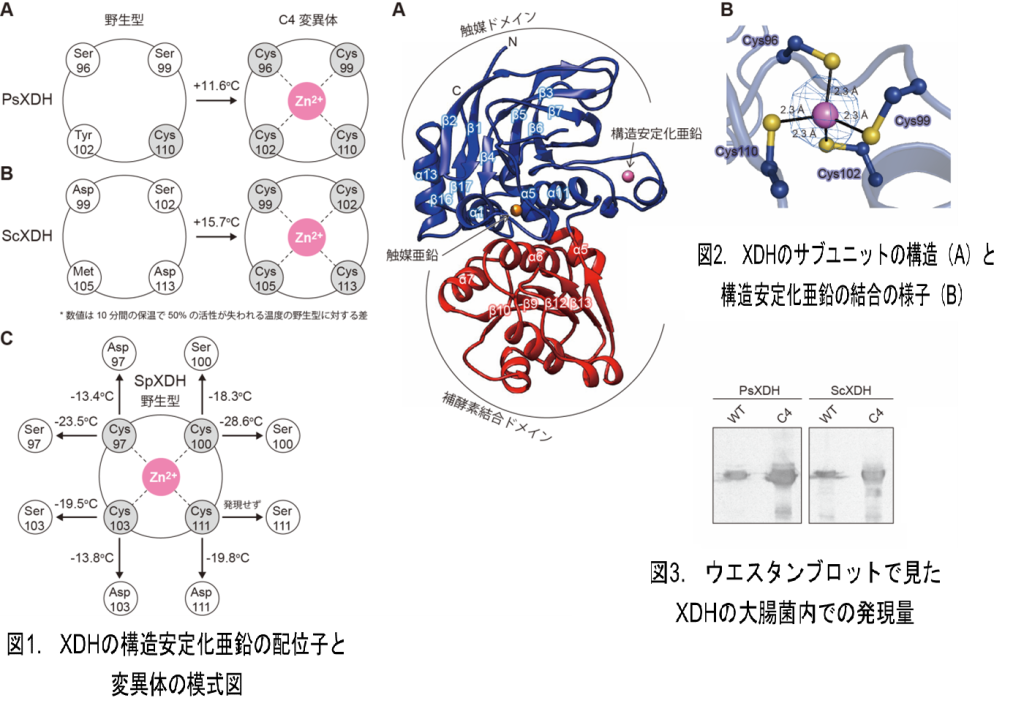
XDHは、Medium-chain dehydrogenase/reductase(MDR)タンパク質ファミリーに属する酵素で、活性中心に亜鉛原子を有しています(触媒亜鉛)。MDRタンパク質の多くはさらにもう一つ亜鉛原子(構造安定化亜鉛)を含んでおり、大半の配位子の4つのシステインです。一方、PsXDHはこれらのシステインのうち1個しか持たず、構造安定化亜鉛も含みません(図1A)。そこで、部位特異的に残りのシステインを導入したものがC4変異体で、野生型に比べて安定性が著しく向上しており、これが構造決定に用いられました(参考文献1)。PsXDHの全体構造は触媒ドメインと補酵素結合ドメインからなり、主鎖の折りたたみは他のMDRタンパク質とよく重なりました(図2A)。C4変異体のサブユニット当たりの亜鉛の個数は2個と見積もられていましたが、野生型に比べて増加した分の亜鉛が4つのシステインに配位している様子が明瞭に確認できました(図2B)。
MDRタンパク質ファミリーにおける未解決の大きな疑問は、構造安定化亜鉛の正確な機能となぜこれを持つものと持たないものが存在するのかということでした。なぜなら、配位子であるシステインをアラニンに置換すると活性がほぼなくなったり構造が維持できなくなったりするため、機能的に有利な構造安定化亜鉛をあえて失わせるような進化が説明できないからです。そこで今回は、固有に構造安定化亜鉛を持つ分裂酵母(Schizosaccharomyces pombe)由来XDH(SpXDH)を用いて、4つのシステインをセリンとアスパラギンに置換しました。なぜなら、これらのアミノ酸残基はPsXDHなど構造安定化亜鉛を持たないタンパク質のシステインの位置に頻繁に存在するからです。作成したセリン変異体のほとんどは、十分な活性を維持していた一方で熱安定性は著しく低下していました(図1C)。一方、すべてのアスパラギン酸変異体ではセリン変異体に比べて熱安定性の低下が抑制されました。
これらの結果より、どのように構造安定化亜鉛を持たないMDRタンパク質が出現したのかという分子進化の道筋を描くことができます。すなわち、システイン配位子がアラニンなどに置換して一気に構造安定化亜鉛が失われたわけではなく、アスパラギン酸のように亜鉛に配位できる置換、さらには構造への影響が少ないセリンへの置換を経て、構造安定化亜鉛を持たないタンパク質に至ったと考えられます。構造安定化亜鉛の消失で低下した安定性でも、細胞の生存に不利に働かず活性に大きな影響を与えなければ、中立変異として残ることができます。
4つのシステインを一つも持たないS. cerevisiae 由来XDH(ScXDH)にC4変異を導入しても、PsXDHと同様の熱安定化が達成できこの手法の普遍性が証明されました(図1B)。これらのC4変異体は、大腸菌内での発現量が野生型に比べ大幅に増加しました(図3)。また、SpXDHの熱安定性はPsXDHやScXDHのC4変異体よりはるかに高いものでした。こうした酵素を使うことで前述のキシリトールの蓄積を抑制しD-キシロース発酵を改善できれば、バイオエタノールに限らずあらゆる有用化成品をリグノセルロース系バイオマスから生産するグリーンケミストリーに貢献できると考えられます。
論文情報
掲載誌:Scientific Reports 13, 1920 (2023)
題 名:Molecular evolutionary insight of structural zinc atom in yeast xylitol dehydrogenases and its application in bioethanol production by lignocellulosic biomass.
(酵母菌の持つキシリトール脱水素酵素に含まれる構造安定化亜鉛の分子進化的知見、およびそのリグノセルロース系バイオマスからのバイオエタノール生産への応用)
著 者:吉原健太郎1#、渡辺誠也1,2#*、渡邊康紀3
1 愛媛大学大学院農学研究科
2 愛媛大学沿岸環境科学研究センター
3 山形大学理学部
*責任著者
#共筆頭著者
DOI:10.1038/s41598-023-29195-7
参考文献
Watanabe, S., Kodaki, T., Makino, K. (2005) Complete reversal of coenzyme specificity of xylitol dehydrogenase and increase of thermostability by the introduction of structural zinc. Journal of Biological Chemistry 280, 10340-10349.
参考Webサイト
<大学院農学研究科>